

A força de encolhimento de qualquer comprimento de unidade na superfície do líquido é chamada de tensão superficial e a unidade é N. · M-1.

A propriedade de reduzir a tensão superficial do solvente é chamada de atividade da superfície, e uma substância com essa propriedade é chamada de substância ativa na superfície.
A substância ativa na superfície que pode ligar moléculas em solução aquosa e formar micelas e outras associações, e ter alta atividade superficial, além de ter o efeito de umedecimento, emulsificante, espuma, lavagem etc. é chamado de surfactante.
O surfactante são os compostos orgânicos com estrutura e propriedade especial, que podem alterar significativamente a tensão interfacial entre duas fases ou a tensão superficial de líquidos (geralmente água), com umedecimento, espuma, emulsificante, lavagem e outras propriedades.
Em termos de estrutura, os surfactantes têm uma característica comum, pois contêm dois grupos de natureza diferente em suas moléculas. Em uma extremidade, há uma cadeia longa de grupo não polar, solúvel em petróleo e insolúvel em água, também conhecido como grupo hidrofóbico ou grupo repelente à água. Esse grupo repelente à água geralmente é longas cadeias de hidrocarbonetos, às vezes também para flúor orgânico, silício, organofosfato, cadeia de organotina, etc. Na outra extremidade, é o grupo solúvel em água, um grupo hidrofílico ou grupo repelente de petróleo. O grupo hidrofílico deve ser suficientemente hidrofílico para garantir que os surfactantes inteiros sejam solúveis em água e tenham a solubilidade necessária. Como os surfactantes contêm grupos hidrofílicos e hidrofóbicos, eles podem ser solúveis em pelo menos uma das fases líquidas. Esta propriedade hidrofílica e lipofílica do surfactante é chamada de anfifilicidade.


O surfactante é um tipo de moléculas anfifílicas com grupos hidrofóbicos e hidrofílicos. Grupos hidrofóbicos de surfactantes são geralmente compostos por hidrocarbonetos de cadeia longa, como alquil C8 ~ C20 de cadeia reta, alquil C8 ~ C20 , alquilfenil (número de TOM de alquil carbono é 8 ~ 16) e similares. A diferença pequena entre os grupos hidrofóbicos está principalmente nas alterações estruturais das cadeias de hidrocarbonetos. E os tipos de grupos hidrofílicos são mais, portanto, as propriedades dos surfactantes estão principalmente relacionadas a grupos hidrofílicos, além do tamanho e forma dos grupos hidrofóbicos. As alterações estruturais dos grupos hidrofílicas são maiores que as dos grupos hidrofóbicos; portanto, a classificação de surfactantes geralmente se baseia na estrutura dos grupos hidrofílicos. Essa classificação se baseia se o grupo hidrofílico é iônico ou não e é dividido em tipos aniônicos, catiônicos, não iônicos, zwitteriônicos e outros surfactantes.

① Adsorção de surfactantes no interfac
Moléculas de surfactante são moléculas anfifílicas com grupos lipofílicos e hidrofílicos. Quando o surfactante é dissolvido na água, seu grupo hidrofílico é atraído pela água e se dissolve na água, enquanto seu grupo lipofílico é repelido pela água e deixa a água, resultando na adsorção de moléculas de surfactante (ou íons) na interface das duas fases, que reduz a tensão interfacial entre as duas fases. Quanto mais moléculas de surfactante (ou íons) são adsorvidas na interface, maior a redução na tensão interfacial.
② Algumas propriedades da membrana de adsorção
Pressão da superfície da membrana de adsorção: adsorção de surfactante na interface gás-líquido para formar uma membrana de adsorção, como colocar uma folha flutuante removível sem fricção na interface, a folha flutuante empurra a membrana adsorvente ao longo da superfície da solução e a membrana gera uma pressão flutuante, que é chamada de pressão.
Viscosidade da superfície: como a pressão da superfície, a viscosidade da superfície é uma propriedade exibida pela membrana molecular insolúvel. Suspenso por um anel de platina de fio de metal fino, de modo que seu plano entre em contato com a superfície da água do tanque, gire o anel de platina, o anel de platina pela viscosidade do obstáculo da água, a amplitude gradualmente decai, segundo a qual a viscosidade da superfície pode ser medida. O método é: primeiro, o experimento é realizado na superfície da água pura para medir a decaimento da amplitude e, em seguida, a decaimento após a formação da membrana da superfície é medida e a viscosidade da membrana da superfície é derivada da diferença entre os dois.
A viscosidade da superfície está intimamente relacionada à solidez da membrana da superfície e, como a membrana da adsorção tem pressão e viscosidade da superfície, ela deve ter elasticidade. Quanto maior a pressão da superfície e maior a viscosidade da membrana adsorvida, maior seu módulo elástico. O módulo elástico da membrana de adsorção da superfície é importante no processo de estabilização da bolha.
③ Formação de micelas
Soluções diluídas de surfactantes obedecem às leis seguidas de soluções ideais. A quantidade de surfactante adsorvida na superfície da solução aumenta com a concentração da solução e, quando a concentração atinge ou excede um determinado valor, a quantidade de adsorção não aumenta mais, e essas moléculas de surfactante em excesso estão na solução de uma maneira ou de alguma maneira regular. Tanto a prática quanto a teoria mostram que formam associações em solução, e essas associações são chamadas de micelas.
Concentração crítica de micelas (CMC): A concentração mínima na qual os surfactantes formam micelas em solução é chamada de concentração crítica de micelas.
④ Valores CMC de surfactantes comuns.

HLB é a abreviação do equilíbrio lipofilo hidrofilo, que indica o equilíbrio hidrofílico e lipofílico dos grupos hidrofílicos e lipofílicos do surfactante, ou seja, o valor HLB do surfactante. Um grande valor de HLB indica uma molécula com forte hidrofilicidade e lipofilicidade fraca; Por outro lado, forte lipofilicidade e hidrofilicidade fraca.
① Disposições do valor HLB
O valor do HLB é um valor relativo; portanto, quando o valor HLB é desenvolvido, como padrão, o valor HLB da cera de parafina, que não possui propriedades hidrofílicas, é especificado como 0, enquanto o valor HLB de dodecil de sódio, que é mais solúvel em água, o valor de sflb, geralmente, o valor do HLB, que é o que é mais 40. são lipofílicos, enquanto os maiores que 10 são hidrofílicos. Assim, o ponto de virada do lipofílico para o hidrofílico é de cerca de 10.
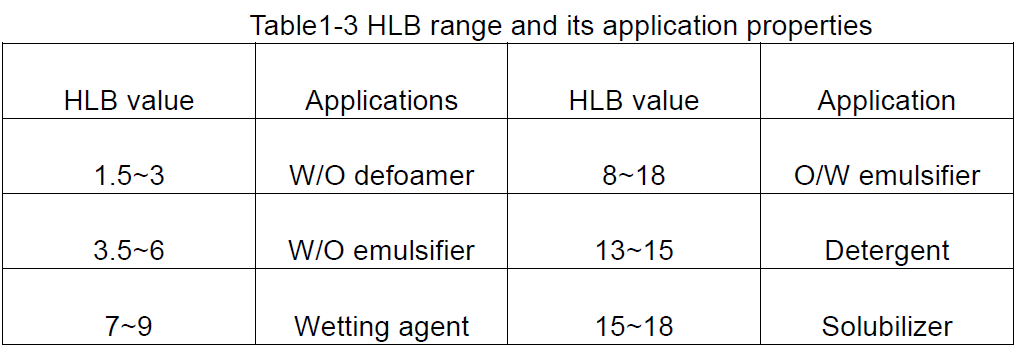
Com base nos valores de HLB dos surfactantes, uma idéia geral de seus usos possíveis pode ser obtida, conforme mostrado na Tabela 1-3.

Dois líquidos mutuamente insolúveis, um disperso na outra como partículas (gotículas ou cristais líquidos) formam um sistema chamado emulsão. Esse sistema é termodinamicamente instável devido ao aumento da área de limite dos dois líquidos quando a emulsão é formada. Para tornar a emulsão estável, é necessário adicionar um terceiro componente - emulsificante para reduzir a energia interfacial do sistema. O emulsificante pertence ao surfactante, sua principal função é desempenhar o papel da emulsão. A fase da emulsão que existe como gotículas é chamada de fase dispersa (ou fase interna, fase descontínua), e a outra fase vinculada é chamada de meio de dispersão (ou fase externa, fase contínua).
① Emulsificantes e emulsões
Common emulsions, one phase is water or aqueous solution, the other phase is organic substances not miscible with water, such as grease, wax, etc. The emulsion formed by water and oil can be divided into two types according to their dispersion situation: oil dispersed in water to form oil-in-water type emulsion, expressed as O/W (oil/water): water dispersed in oil to form oil-in-water type emulsion, expressed as W/O (water/oil). Também podem ser formados o tipo de água em óleo em água na água e o tipo de óleo O/O do tipo de óleo em óleo em óleo.
Os emulsificantes são usados para estabilizar emulsões, reduzindo a tensão interfacial e formando a membrana interfacial de molécula única.
Na emulsificação dos requisitos do emulsificante:
R: O emulsificante deve ser capaz de adsorver ou enriquecer a interface entre as duas fases, para que a tensão interfacial seja reduzida;
B: O emulsificante deve dar as partículas à carga, de modo que a repulsão eletrostática entre as partículas ou forma uma membrana protetora estável e altamente viscosa ao redor das partículas.
Portanto, a substância usada como emulsificante deve ter grupos anfifílicos para emulsificar, e os surfactantes podem atender a esse requisito.
② Métodos de preparação de emulsões e fatores que afetam a estabilidade das emulsões
Existem duas maneiras de preparar emulsões: uma é usar o método mecânico para dispersar o líquido em pequenas partículas em outro líquido, que é usado principalmente na indústria para preparar emulsões; O outro é dissolver o líquido no estado molecular em outro líquido e depois fazê -lo se reunir adequadamente para formar emulsões.
A estabilidade de uma emulsão é a capacidade de agregação anti-partícula que leva à separação de fases. As emulsões são sistemas termodinamicamente instáveis com grande energia livre. Portanto, a chamada estabilidade de uma emulsão é na verdade o tempo necessário para que o sistema atinja o equilíbrio, ou seja, o tempo necessário para a separação de um dos líquidos no sistema.
Quando a membrana interfacial com álcoois gordurosos, ácidos graxos e aminas gordurosas e outras moléculas orgânicas polares, a força da membrana significativamente maior. Isso ocorre porque, na camada de adsorção interfacial de moléculas e álcoois emulsificantes, ácidos e aminas e outras moléculas polares para formar um "complexo", de modo que a força da membrana interfacial aumentou.
Os emulsificantes que consistem em mais de dois surfactantes são chamados de emulsificantes mistos. Emulsificante misto adsorvido na interface de água/óleo; A ação intermolecular pode formar complexos. Devido à forte ação intermolecular, a tensão interfacial é significativamente reduzida, a quantidade de emulsificante adsorvida na interface aumenta significativamente, a formação da densidade interfacial da membrana aumenta, a força aumenta.
A carga das contas líquidas tem um efeito significativo na estabilidade da emulsão. Emulsões estáveis, cujas contas líquidas geralmente são carregadas. Quando um emulsificante iônico é usado, o emulsificante de íons adsorvido na interface tem seu grupo lipofílico inserido na fase oleosa e o grupo hidrofílico está na fase aquática, tornando as contas líquidas carregadas. À medida que as contas de emulsão com a mesma carga, elas se repelem, não fáceis de aglomerar, para que a estabilidade seja aumentada. Pode -se observar que quanto mais os íons emulsificantes adsorvam nas contas, maior a carga, maior a capacidade de impedir que as contas aglomeração, mais estável o sistema de emulsão.
A viscosidade do meio de dispersão de emulsão tem uma certa influência na estabilidade da emulsão. Geralmente, quanto maior a viscosidade do meio de dispersão, maior a estabilidade da emulsão. Isso ocorre porque a viscosidade do meio de dispersão é grande, o que tem um forte efeito no movimento browniano das contas líquidas e diminui a colisão entre as contas líquidas, para que o sistema permaneça estável. Geralmente, as substâncias poliméricas que podem ser dissolvidas em emulsões podem aumentar a viscosidade do sistema e aumentar a estabilidade das emulsões. Além disso, os polímeros também podem formar uma forte membrana interfacial, tornando o sistema de emulsão mais estável.
Em alguns casos, a adição de pó sólido também pode fazer com que a emulsão tenda a se estabilizar. O pó sólido está na água, óleo ou interface, dependendo do óleo, a água na capacidade de umedecimento do pó sólido, se o pó sólido não estiver completamente molhado com água, mas também molhado por óleo, permanecerá na interface de água e óleo.
O pó sólido não torna a emulsão estável porque o pó reunido na interface aumenta a membrana interfacial, que é semelhante à adsorção interfacial de moléculas de emulsificantes; portanto, quanto mais intimamente o material de pó sólido é organizado na interface, mais estável é a emulsão.
Os surfactantes têm a capacidade de aumentar significativamente a solubilidade de substâncias orgânicas insolúveis ou ligeiramente solúveis em água após a formação de micelas em solução aquosa, e a solução é transparente no momento. Esse efeito da micelle é chamado de solubilização. O surfactante que pode produzir solubilização é chamado solubilizador, e a matéria orgânica solubilizada é chamada de matéria solubilizada.

A espuma desempenha um papel importante no processo de lavagem. A espuma é um sistema de dispersão no qual um gás é disperso em um líquido ou sólido, com o gás como a fase dispersa e o líquido ou sólido como o meio de dispersão, sendo o primeiro chamado de espuma líquida, enquanto o último é chamado de espuma sólida, como plástico espumado, vidro espumado, cimento de espuma etc.
(1) Formação de espuma
Por espuma, queremos dizer aqui um agregado de bolhas de ar separadas por uma membrana líquida. Esse tipo de bolha sempre aumenta rapidamente para a superfície do líquido devido à grande diferença na densidade entre a fase dispersa (gás) e o meio de dispersão (líquido), combinado com a baixa viscosidade do líquido.
O processo de formação de uma bolha é trazer uma grande quantidade de gás para o líquido, e as bolhas no líquido retornam rapidamente à superfície, formando um agregado de bolhas separadas por uma pequena quantidade de gás líquido.
A espuma tem duas características significativas em termos de morfologia: uma é que as bolhas como uma fase dispersa são frequentemente de forma poliédrica, isso ocorre porque, na interseção das bolhas, há uma tendência para o filme líquido diminuir para que as bolhas se tornem poliédricas, quando o filme líquido derruba em certa medida, leva a borbulhar a ruptura; A segunda é que líquidos puros não podem formar espuma estável, o líquido que pode formar espuma é de pelo menos dois ou mais componentes. Soluções aquosas de surfactantes são típicas de sistemas propensos à geração de espuma, e sua capacidade de gerar espuma também está relacionada a outras propriedades.
Os surfactantes com bom poder de espuma são chamados de agentes de espuma. Embora o agente de espuma tenha uma boa capacidade de espuma, a espuma formada pode não ser capaz de manter muito tempo, ou seja, sua estabilidade não é necessariamente boa. Para manter a estabilidade da espuma, geralmente no agente espumante para adicionar substâncias que podem aumentar a estabilidade da espuma, a substância é chamada estabilizadora de espuma, o estabilizador comumente usado é a dietanolamina e o óxido de dodecilamina lauril.
(2) estabilidade da espuma
A espuma é um sistema termodinamicamente instável e a tendência final é que a área de superfície total do líquido dentro do sistema diminui após a quebra da bolha e a energia livre diminui. O processo de defesa é o processo pelo qual a membrana líquida que separa o gás se torna mais espessa e mais fina até quebrar. Portanto, o grau de estabilidade da espuma é determinado principalmente pela velocidade da descarga líquida e pela força do filme líquido. Os seguintes fatores também influenciam isso.
(3) Destruição de espuma
O princípio básico da destruição de espuma é alterar as condições que produzem a espuma ou eliminar os fatores estabilizadores da espuma; portanto, existem métodos físicos e químicos de dono.
A doação física significa alterar as condições da produção de espuma, mantendo a composição química da solução de espuma, como distúrbios externos, alterações de temperatura ou pressão e tratamento ultrassônico são métodos físicos eficazes para eliminar a espuma.
O método químico de infiltração é adicionar certas substâncias para interagir com o agente de espuma para reduzir a força do filme líquido na espuma e, assim, reduzir a estabilidade da espuma para alcançar o objetivo do doenamento, essas substâncias são chamadas de falsificadores. A maioria dos inabalistas são surfactantes. Portanto, de acordo com o mecanismo de doação, o DeFoamer deve ter uma forte capacidade de reduzir a tensão superficial, fácil de adsorver na superfície, e a interação entre as moléculas de adsorção da superfície é fraca, as moléculas de adsorção dispostas em uma estrutura mais solta.
Existem vários tipos de defoâmer, mas basicamente, todos são surfactantes não iônicos. Os surfactantes não iônicos possuem propriedades anti-espumantes próximas ou acima do ponto de nuvem e são frequentemente usadas como inabalistas. Os álcoois, especialmente os álcoois com estrutura de ramificação, ácidos graxos e ésteres de ácidos graxos, poliamidas, ésteres de fosfato, óleos de silicone etc. também são comumente usados como excelentes infilos.
(4) espuma e lavagem
Não existe um vínculo direto entre a eficácia da espuma e a lavagem e a quantidade de espuma não indica a eficácia da lavagem. Por exemplo, surfactantes não iônicos têm muito menos propriedades de espuma do que os sabonetes, mas sua descontaminação é muito melhor do que os sabonetes.
Em alguns casos, a espuma pode ser útil na remoção de sujeira e sujeira. Por exemplo, ao lavar a louça em casa, a espuma do detergente pega as gotículas de óleo e, ao esfregar tapetes, a espuma ajuda a pegar poeira, pó e outra sujeira sólida. Além disso, a espuma às vezes pode ser usada como uma indicação da eficácia de um detergente. Como os óleos gordurosos têm um efeito inibidor na espuma do detergente, quando houver muito óleo e muito pouco detergente, nenhuma espuma será gerada ou a espuma original desaparecerá. Às vezes, a espuma também pode ser usada como um indicador da limpeza de uma enxágue, pois a quantidade de espuma na solução de enxágue tende a diminuir com a redução do detergente, para que a quantidade de espuma possa ser usada para avaliar o grau de enxágue.
Em um sentido amplo, a lavagem é o processo de remover componentes indesejados do objeto a ser lavado e alcançar algum objetivo. Lavar no sentido usual refere -se ao processo de remoção de sujeira da superfície do transportador. Na lavagem, a interação entre a sujeira e o transportador é enfraquecida ou eliminada pela ação de algumas substâncias químicas (por exemplo, detergente etc.), de modo que a combinação de sujeira e transportadora é alterada para a combinação de sujeira e detergente e, finalmente, a sujeira é separada da transportadora. Como os objetos a serem lavados e a sujeira a ser removida são diversos, a lavagem é um processo muito complexo e o processo básico de lavagem pode ser expresso nos seguintes relacionamentos simples.
Carrie ·· sujeira + detergente = transportadora + sujeira · detergente
O processo de lavagem geralmente pode ser dividido em dois estágios: primeiro, sob a ação do detergente, a sujeira é separada de sua transportadora; Em segundo lugar, a sujeira destacada é dispersa e suspensa no meio. O processo de lavagem é um processo reversível e a sujeira dispersa e suspensa no meio também pode ser re-precipitada do meio para o objeto que está sendo lavado. Portanto, um bom detergente deve ter a capacidade de dispersar e suspender a sujeira e impedir a redução da sujeira, além da capacidade de remover a sujeira da transportadora.
(1) tipos de sujeira
Mesmo para o mesmo item, o tipo, a composição e a quantidade de sujeira podem variar dependendo do ambiente em que é usado. A sujeira do corpo do óleo é principalmente alguns óleos de animais e vegetais e óleos minerais (como óleo bruto, óleo combustível, alcatrão de carvão etc.), a sujeira sólida é principalmente fuligem, cinzas, ferrugem, preto de carbono etc. Em termos de sujeira, há sujeira do corpo humano, como suor, sebo, sangue, etc.; sujeira de alimentos, como manchas de frutas, manchas de óleo de cozinha, manchas de condimentos, amido, etc.; sujeira de cosméticos, como batom, esmalte, etc.; sujeira da atmosfera, como fuligem, poeira, lama, etc.; Outros, como tinta, chá, revestimento, etc. Ele vem em vários tipos.
Os vários tipos de sujeira geralmente podem ser divididos em três categorias principais: sujeira sólida, sujeira líquida e sujeira especial.
① sujeira sólida
A sujeira sólida comum inclui partículas de cinzas, lama, terra, ferrugem e preto de carbono. A maioria dessas partículas tem uma carga elétrica em sua superfície, a maioria delas é carregada negativamente e pode ser facilmente adsorvida em itens de fibra. A sujeira sólida é geralmente difícil de dissolver na água, mas pode ser dispersa e suspensa por soluções de detergente. A sujeira sólida com ponto de massa menor é mais difícil de remover.
② sujeira líquida
A sujeira líquida é principalmente solúvel em óleo, incluindo óleos vegetais e animais, ácidos graxos, álcoois graxos, óleos minerais e seus óxidos. Entre eles, podem ocorrer óleos vegetais e animais, ácidos graxos e saponificação de álcalis, enquanto os álcoois gordurosos, os óleos minerais não são saponificados por álcalis, mas podem ser solúveis em solventes de álcoois, éteres e hidrocarbonetos e emulsificação e dispersão da solução de água detergente. A sujeira líquida solúvel em óleo geralmente tem uma força forte com itens de fibra e é mais firmemente adsorvida nas fibras.
③ Sujeira especial
A sujeira especial inclui proteínas, amido, sangue, secreções humanas, como suor, sebo, suco de urina e frutas e suco de chá. A maior parte desse tipo de sujeira pode ser quimicamente e fortemente adsorvida em itens de fibra. Portanto, é difícil lavar.
Os vários tipos de sujeira raramente são encontrados sozinhos, mas geralmente são misturados e adsorvidos no objeto. Às vezes, a sujeira pode ser oxidada, decomposta ou deteriorada sob influências externas, criando assim uma nova sujeira.
(2) Adesão da sujeira
Roupas, mãos etc. podem ser manchadas porque há algum tipo de interação entre o objeto e a sujeira. A sujeira adere aos objetos de várias maneiras, mas não há mais do que aderências físicas e químicas.
①A adesão à fuligem, poeira, lama, areia e carvão à roupa é uma adesão física. De um modo geral, através dessa adesão da sujeira, e o papel entre o objeto manchado é relativamente fraco, a remoção da sujeira também é relativamente fácil. De acordo com as diferentes forças, a adesão física da sujeira pode ser dividida em adesão mecânica e adesão eletrostática.
A: adesão mecânica
Esse tipo de adesão refere -se principalmente à adesão de alguma sujeira sólida (por exemplo, poeira, lama e areia). A adesão mecânica é uma das formas mais fracas de adesão da sujeira e pode ser removida quase por meios puramente mecânicos, mas quando a sujeira é pequena (<0,1um), é mais difícil remover.
B : Adesão eletrostática
A adesão eletrostática é manifestada principalmente na ação de partículas de sujeira carregadas em objetos de carga oposta. A maioria dos objetos fibrosos é carregada negativamente na água e pode ser facilmente respeitada por certa sujeira carregada positivamente, como os tipos de cal. Alguma sujeira, embora carregada negativamente, como partículas pretas de carbono em soluções aquosas, podem aderir às fibras através de pontes iônicas (íons entre múltiplos objetos de carga oposta, agindo em conjunto com eles de maneira semelhante à ponte) formados por íons positivos na água (por exemplo, Ca2+ , mg2+ etc.).
A ação eletrostática é mais forte que a ação mecânica simples, dificultando a remoção de sujeira.
② Adesão química
A adesão química refere -se ao fenômeno da sujeira que atua em um objeto através de ligações químicas ou de hidrogênio. Por exemplo, sujeira sólida polar, proteína, ferrugem e outra adesão em itens de fibra, fibras contêm carboxil, hidroxil, amida e outros grupos, esses grupos e ácidos graxos de sujeira oleosa, álcoois graxos são fáceis de formar ligações de hidrogênio. As forças químicas são geralmente fortes e a sujeira é, portanto, mais firmemente ligada ao objeto. É difícil remover esse tipo de sujeira pelos métodos usuais e requer métodos especiais para lidar com isso.
O grau de adesão da sujeira está relacionado à natureza da própria sujeira e à natureza do objeto ao qual é aderido. Geralmente, as partículas aderem facilmente a itens fibrosos. Quanto menor a textura da sujeira sólida, mais forte a adesão. Sujeira polar em objetos hidrofílicos, como algodão e vidro, aderem mais fortemente do que a sujeira não polar. A sujeira não polar adere mais fortemente do que a sujeira polar, como gorduras polares, poeira e argila, e é menos fácil de remover e limpar.
(3) mecanismo de remoção de sujeira
O objetivo da lavagem é remover a sujeira. Em um meio de uma certa temperatura (principalmente água). Usando os vários efeitos físicos e químicos do detergente para enfraquecer ou eliminar o efeito da sujeira e objetos lavados, sob a ação de certas forças mecânicas (como esfregamento manual, agitação da máquina de lavar, impacto na água), de modo que a sujeira e objetos lavados do objetivo da descontaminação.
① Mecanismo de remoção de sujeira líquida
A : Molhado
A sujeira líquida é principalmente à base de petróleo. As manchas de óleo molham a maioria dos itens fibrosos e se espalham mais ou menos como um filme de óleo na superfície do material fibroso. O primeiro passo na ação de lavagem é o umedecimento da superfície pelo líquido de lavagem. Por uma questão de ilustração, a superfície de uma fibra pode ser considerada uma superfície sólida lisa.
B: Desconfiança de óleo - mecanismo de curling
O segundo passo na ação de lavagem é a remoção de óleo e graxa, a remoção da sujeira líquida é alcançada por uma espécie de enrolamento. A sujeira líquida existia originalmente na superfície na forma de um filme de óleo espalhado e, sob o efeito de umedecimento preferencial do líquido de lavagem na superfície sólida (ou seja, a superfície da fibra), ele se enrolou em contas de óleo passo a passo, que foram substituídas pelo líquido de lavagem e, eventualmente, deixavam a superfície sob certas forças externas.
② Mecanismo de remoção de sujeira sólida
A remoção da sujeira líquida é principalmente através da umidade preferencial do transportador de sujeira pela solução de lavagem, enquanto o mecanismo de remoção para sujeira sólida é diferente, onde o processo de lavagem é principalmente sobre o umedecimento da massa de sujeira e sua superfície do transportador pela solução de lavagem. Devido à adsorção de surfactantes na sujeira sólida e em sua superfície do transportador, a interação entre a sujeira e a superfície é reduzida e a resistência à adesão da massa de sujeira na superfície é reduzida, portanto a massa de sujeira é facilmente removida da superfície do transportador.
Além disso, a adsorção de surfactantes, especialmente surfactantes iônicos, na superfície da sujeira sólida e seu transportador tem o potencial de aumentar o potencial da superfície na superfície da sujeira sólida e seu transportador, o que é mais propício à remoção da sujeira. As superfícies sólidas ou geralmente fibrosas são geralmente carregadas negativamente em meios aquosos e, portanto, podem formar camadas eletrônicas duplas difusas em massas de sujeira ou superfícies sólidas. Devido à repulsão de cargas homogêneas, a adesão de partículas de sujeira na água à superfície sólida é enfraquecida. Quando um surfactante aniônico é adicionado, porque pode aumentar simultaneamente o potencial da superfície negativa da partícula de sujeira e a superfície sólida, a repulsão entre eles é mais aprimorada, a resistência à adesão da partícula é mais reduzida e a sujeira é mais fácil de remover.
Os surfactantes não iônicos são adsorvidos em superfícies sólidas geralmente carregadas e, embora não alterem significativamente o potencial interfacial, os surfactantes não iônicos adsorvidos tendem a formar uma certa espessura da camada adsorvida na superfície, o que ajuda a impedir a descendência da sujeira.
No caso de surfactantes catiônicos, sua adsorção reduz ou elimina o potencial superficial negativo da massa de sujeira e sua superfície do transportador, o que reduz a repulsão entre a sujeira e a superfície e, portanto, não é conducente à remoção da sujeira; Além disso, após a adsorção na superfície sólida, os surfactantes catiônicos tendem a girar a superfície sólida hidrofóbica e, portanto, não são propícios para a umidade da superfície e, portanto, lavagem.
③ Remoção de solos especiais
Proteínas, amido, secreções humanas, suco de frutas, suco de chá e outras sujeiras são difíceis de remover com surfactantes normais e requerem tratamento especial.
Manchas de proteínas, como creme, ovos, sangue, leite e excremes de pele, tendem a coagular as fibras e a degeneração e a obter mais forte adesão. A sujeira de proteínas pode ser removida usando proteases. A protease enzimática quebra as proteínas na sujeira em aminoácidos ou oligopeptídeos solúveis em água.
As manchas de amido vêm principalmente de alimentos, outros como molho, cola etc. amilase tem um efeito catalítico na hidrólise das manchas de amido, fazendo com que o amido se divida em açúcar.
A lipase catalisa a decomposição dos triglicerídeos, difíceis de remover por métodos normais, como sebo e óleos comestíveis, e os quebra em glicerol solúvel e ácidos graxos.
Algumas manchas coloridas de sucos de frutas, sucos de chá, tintas, batom etc. geralmente são difíceis de limpar bem, mesmo após a lavagem repetida. Essas manchas podem ser removidas por uma reação redox com um agente oxidante ou redutor, como o alvejante, que destrói a estrutura dos grupos geradores de cores ou de cor-a-atuexiliar e os degrada em componentes menores de água solúvel.
(4) Mecanismo de remoção de manchas de limpeza a seco
O exposto acima é realmente para a água como meio de lavagem. De fato, devido aos diferentes tipos de roupas e estrutura, algumas roupas usando lavagem de água não são convenientes ou não são fáceis de lavar, algumas roupas após a lavagem e até deformação, desbotamento, etc., por exemplo: a maioria das fibras naturais absorve água e fácil de inchar e secar e encolher, portanto, após a lavagem será deformada; Ao lavar a lã, os produtos também geralmente parecem fenômenos de encolhimento, alguns produtos de lã com lavagem de água também são fáceis de seleção, mudança de cor; Algumas mãos de sedas sentirem pior após a lavagem e perdem o brilho. Para essas roupas, geralmente usam o método de limpeza a seco para descontaminar. A chamada limpeza a seco geralmente se refere ao método de lavagem em solventes orgânicos, especialmente em solventes não polares.
A limpeza a seco é uma forma mais suave de lavagem do que a lavagem da água. Como a limpeza a seco não requer muita ação mecânica, ela não causa danos, rugas e deformação às roupas, enquanto os agentes de limpeza a seco, ao contrário da água, raramente produzem expansão e contração. Enquanto a tecnologia for manuseada adequadamente, as roupas podem ser limpas a seco sem distorção, desbotamento de cores e vida útil prolongada.
Em termos de limpeza a seco, existem três tipos amplos de sujeira.
A sujeira solúvel em sujeira solúvel em óleo solúvel inclui todos os tipos de óleo e graxa, que são líquidos ou oleosos e podem ser dissolvidos em solventes de limpeza a seco.
A sujeira solúvel em sujeira solúvel em água é solúvel em soluções aquosas, mas não em agentes de limpeza a seco, é adsorvida em roupas em um estado aquoso, a água evapora após a precipitação de sólidos granulares, como sais inorgânicos, amido, proteína, etc.
③Oil e água insolúvel O óleo de sujeira e a sujeira insolúvel em água não é solúvel em água nem solúvel em solventes de limpeza a seco, como preto de carbono, silicatos de vários metais e óxidos, etc.
Devido à natureza diferente de vários tipos de sujeira, existem diferentes maneiras de remover a sujeira no processo de limpeza a seco. Os solos solúveis em óleo, como óleos de animais e vegetais, óleos minerais e graxas, são facilmente solúveis em solventes orgânicos e podem ser removidos mais facilmente na limpeza a seco. A excelente solubilidade de solventes de limpeza a seco para óleos e graxas vem essencialmente das forças de Van der Walls entre moléculas.
Para a remoção de sujeira solúvel em água, como sais inorgânicos, açúcares, proteínas e suor, a quantidade certa de água também deve ser adicionada ao agente de limpeza a seco, caso contrário, é difícil remover a sujeira solúvel em água. No entanto, é difícil dissolver a água no agente de limpeza a seco; portanto, para aumentar a quantidade de água, você também precisa adicionar surfactantes. A presença de água no agente de limpeza a seco pode tornar a superfície da sujeira e das roupas hidratadas, de modo que é fácil interagir com os grupos polares de surfactantes, o que é propício à adsorção de surfactantes na superfície. Além disso, quando os surfactantes formam micelas, a sujeira solúvel em água e a água podem ser solubilizadas nas micelas. Além de aumentar o teor de água do solvente de limpeza a seco, os surfactantes também podem desempenhar um papel na prevenção da re-deposição da sujeira para melhorar o efeito de descontaminação.
A presença de uma pequena quantidade de água é necessária para remover a sujeira solúvel em água, mas muita água pode causar distorção e ruga em algumas roupas, de modo que a quantidade de água no agente de limpeza a seco deve ser moderada.
A sujeira que não é solúvel em água nem solúvel em óleo, partículas sólidas, como cinzas, lama, terra e preto de carbono, é geralmente preso à peça de roupa por forças eletrostáticas ou em combinação com o óleo. In dry cleaning, the flow of solvent, impact can make the electrostatic force adsorption of dirt off, and dry-cleaning agent can dissolve the oil, so that the combination of oil and dirt and attached to the clothing of solid particles off in the dry-cleaning agent, dry cleaning agent in a small amount of water and surfactants, so that those off the solid dirt particles can be stable suspension, dispersion, to prevent its re-deposition to the clothing.
(5) fatores que afetam a ação de lavagem
A adsorção direcional de surfactantes na interface e a redução da tensão da superfície (interfacial) são os principais fatores na remoção da sujeira líquida ou sólida. No entanto, o processo de lavagem é complexo e o efeito de lavagem, mesmo com o mesmo tipo de detergente, é influenciado por muitos outros fatores. Esses fatores incluem a concentração do detergente, a temperatura, a natureza da sujeira, o tipo de fibra e a estrutura do tecido.
① Concentração do surfactante
As micelas dos surfactantes em solução desempenham um papel importante no processo de lavagem. Quando a concentração atinge a concentração crítica de micelas (CMC), o efeito de lavagem aumenta acentuadamente. Portanto, a concentração de detergente no solvente deve ser maior que o valor do CMC para ter um bom efeito de lavagem. No entanto, quando a concentração de surfactante é maior que o valor do CMC, o aumento incremental no efeito de lavagem não é óbvio e não é necessário aumentar muito a concentração de surfactante.
Ao remover o óleo por solubilização, o efeito da solubilização aumenta com o aumento da concentração do surfactante, mesmo quando a concentração está acima do CMC. Neste momento, é aconselhável usar o detergente de maneira centralizada local. Por exemplo, se houver muita sujeira nos punhos e no colarinho de uma roupa, uma camada de detergente pode ser aplicada durante a lavagem para aumentar o efeito solubilizante do surfactante no óleo.
②Temperature tem uma influência muito importante na ação de descontaminação. Em geral, aumentar a temperatura facilita a remoção da sujeira, mas às vezes uma temperatura muito alta também pode causar desvantagens.
O aumento da temperatura facilita a difusão da sujeira, a graxa sólida é facilmente emulsificada a temperaturas acima do ponto de fusão e as fibras aumentam no inchaço devido ao aumento da temperatura, todas facilitadas a remoção da sujeira. No entanto, para tecidos compactos, os microgaps entre as fibras são reduzidos à medida que as fibras se expandem, o que é prejudicial para a remoção da sujeira.
As alterações de temperatura também afetam a solubilidade, o valor CMC e o tamanho da micela dos surfactantes, afetando assim o efeito de lavagem. A solubilidade de surfactantes com cadeias de carbono longas é baixa a baixas temperaturas e, às vezes, a solubilidade é ainda menor que o valor do CMC; portanto, a temperatura de lavagem deve ser aumentada adequadamente. O efeito da temperatura no valor do CMC e no tamanho da micelle é diferente para surfactantes iônicos e não iônicos. Para surfactantes iônicos, um aumento na temperatura geralmente aumenta o valor do CMC e reduz o tamanho do micel, o que significa que a concentração de surfactante na solução de lavagem deve ser aumentada. Para surfactantes não iônicos, um aumento na temperatura leva a uma diminuição no valor do CMC e a um aumento significativo no volume de micelas, por isso fica claro que um aumento apropriado de temperatura ajudará o surfactante não iônico a exercer seu efeito de superfície-ativo. No entanto, a temperatura não deve exceder seu ponto de nuvem.
Em suma, a temperatura ideal de lavagem depende da formulação do detergente e do objeto que está sendo lavado. Alguns detergentes têm um bom efeito detergente à temperatura ambiente, enquanto outros têm uma detergência muito diferente entre lavagem a frio e quente.
③ Espuma
É costume confundir o poder de espuma com o efeito de lavagem, acreditando que os detergentes com alto poder de espuma têm um bom efeito de lavagem. A pesquisa mostrou que não há relação direta entre o efeito de lavagem e a quantidade de espuma. Por exemplo, a lavagem com detergentes com baixa espuma não é menos eficaz do que lavar com altos detergentes de espuma.
Embora a espuma não esteja diretamente relacionada à lavagem, há ocasiões em que ajuda a remover a sujeira, por exemplo, ao lavar a louça à mão. Ao esfregar tapetes, a espuma também pode tirar poeira e outras partículas de sujeira sólida, as contas de sujeira de carpete para uma grande proporção de poeira, para que os agentes de limpeza de carpetes devem ter uma certa capacidade de espuma.
A potência de espuma também é importante para os xampus, onde a espuma fina produzida pelo líquido durante a lavagem ou banho deixa o cabelo que se sente lubrificado e confortável.
④ Variedades de fibras e propriedades físicas de têxteis
Além da estrutura química das fibras, que afeta a adesão e a remoção da sujeira, a aparência das fibras e a organização do fio e do tecido têm influência na facilidade de remoção de sujeira.
As escamas de fibras de lã e as fibras planas curvas de fibras de algodão têm maior probabilidade de acumular sujeira do que fibras lisas. Por exemplo, é fácil remover o preto de carbono em filmes de celulose (filmes de viscose), enquanto o preto de carbono manchado em tecidos de algodão é difícil de lavar. Outro exemplo é que os tecidos de fibra curta feitos de poliéster são mais propensos a acumular manchas de petróleo do que tecidos de fibra longa, e manchas de petróleo em tecidos de fibra curta também são mais difíceis de remover do que manchas de óleo em tecidos de fibra longa.
Fios bem torcidos e tecidos apertados, devido à pequena lacuna entre as fibras, podem resistir à invasão da sujeira, mas o mesmo também pode impedir o líquido de lavagem para excluir a sujeira interna, para que os tecidos apertados comecem a resistir à sujeira boa, mas uma vez manchada de lavagem também é mais difícil.
⑤ dureza da água
A concentração de Ca2+, Mg2+ e outros íons metálicos na água tem uma grande influência no efeito de lavagem, especialmente quando os surfactantes aniônicos encontram íons Ca2+ e Mg2+ que formam sais de cálcio e magnésio que são menos solúveis e reduzirão seu detergente. Em água dura, mesmo que a concentração de surfactante seja alta, a detergência ainda é muito pior do que na destilação. Para que o surfactante tenha o melhor efeito de lavagem, a concentração de íons Ca2+ na água deve ser reduzida para 1 x 10-6 mol/L (CaCO3 a 0,1 mg/L) ou menos. Isso requer a adição de vários amaciadores ao detergente.
Hora de postagem: 25-2022 de fevereiro



